Introduction
L'utilisation de micro-organismes pour la transformation des aliments a été utilisée de façon empirique depuis des millénaires, avant même d'avoir la moindre connaissance sur l'existence d'organismes vivants microscopiques. Ci-dessous quelques repères historiques :
8000 av. J. C. : fabrication du pain et de la bière chez les Sumériens. 5000 av. J. C. : fabrication du vin de palme chez les Babyloniens. 4000 av. J. C. : utilisation des levures pour la fabrication du pain et des boissons alcoolisées en Égypte. 3000 av. J. C. : chou fermenté dans le vin consommé en Chine. |
Le mot fermentation a une racine latine (fervere) qui signifie bouillir. L'appellation est due au dégagement de CO2 avec formation de mousse lors de la fermentation alcoolique.
A une époque beaucoup plus récente, le développement de la microbiologie et de plusieurs autres disciplines scientifiques a non seulement permis de comprendre l'action des micro-organismes, mais en plus de l'orienter et la modifier.
1862 à 1877 : Louis Pasteur s'intéresse aux fermentations. Il étudie des ferments, la formation du vinaigre et de la transformation de l'alcool en acide acétique par Mycoderma aceti. 1900 et 1940 : Développement de la fermentation industrielle avec la production d'acétone, de butanol, de glycérol, d'acide citrique et d'acide lactique. À partir de 1940 : Programmes de sélection et de mutation de souches, productions d'antibiotiques, d'acides aminés, de nucléotides et d'enzymes. A partir de 1980 : Le génie génétique permet l'amélioration des souches microbiennes à fort potentiel industriel. Secteurs d'applications actuels : alimentaire, chimie fine, pharmacie, agro-industrie, cosmétique, etc. |
Aujourd'hui la mise en culture de micro-organismes s'effectue dans plusieurs objectifs :
Faire proliférer les cellules (ex: production de levures de boulangerie)
Utiliser des cellules comme catalyseurs pour la production de molécules d'intérêt ou pour la transformation alimentaire
Il ne s'agit pas d'une réaction comme une autre, puisque la mise en œuvre de cellules vivantes comme catalyseurs présente plusieurs spécificités. Notamment, la quantité de catalyseur est variable au cours du temps, ce qui complique les modèles cinétiques. De plus, ces catalyseurs particuliers présentent des inhibitions et fragilités que ne présentent pas les catalyseurs chimiques.
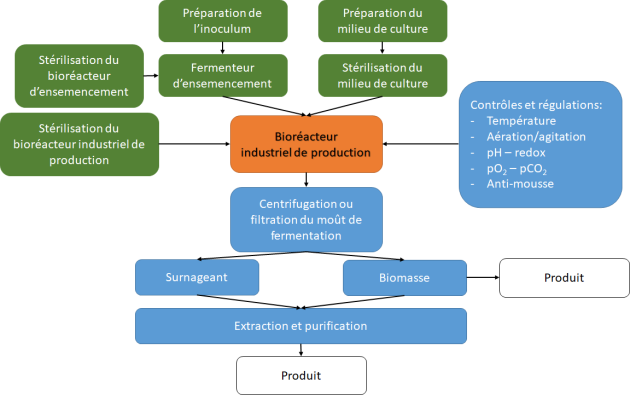
Ces biocatalyseurs vivants sont mis en œuvre dans des fermenteurs, mais le bioprocédé dans lequel ils interviennent comprend plusieurs étapes en amont et en aval de la bioréaction elle-même. Ci-dessous, pour rappel, un schéma synthétique des principales étapes d'un bioprocédé.
Le micro-organisme doit être mis en culture dans les conditions optimales (au regard de l'objectif fixé : les conditions optimales ne sont pas les mêmes pour la production de cellules et pour la production d'une biocine, par exemple). De manière basique et sommaire, un milieu de culture doit comporter au minimum une source d'énergie, de carbone, d'azote, d'ions minéraux. Il est souvent riche en glucose (source de carbone et d'énergie), en peptones (source d'azote aminé), en phosphates, en sulfates, en magnésium. Il peut aussi contenir des vitamines si le micro-organisme n'est pas capable de les synthétiser lui-même.
En fermentation ou culture industrielle, différentes sources de carbone peuvent être utilisés, notamment des déchets d'autres activités industrielles qui peuvent être valorisés. On retrouve à titre d'exemple :
• des mélasses, des résidus visqueux du raffinage de la betterave ou de la canne à sucre, riches en glucides,
• des liquides biologiques : du plasma, du lactosérum (protéines)
• des farines : végétales (maïs riche en amidon ; riz riche en amidon et en protéines ; soja : riche en protéines), de viande (protéines, lipides), de poisson (méthionine, phosphore).
Pour que la culture soit performante, il faut également contrôler les conditions physico-chimiques : température, pH, débit e qualité de l'aération, vitesse d'agitation et caractéristiques des mobiles.
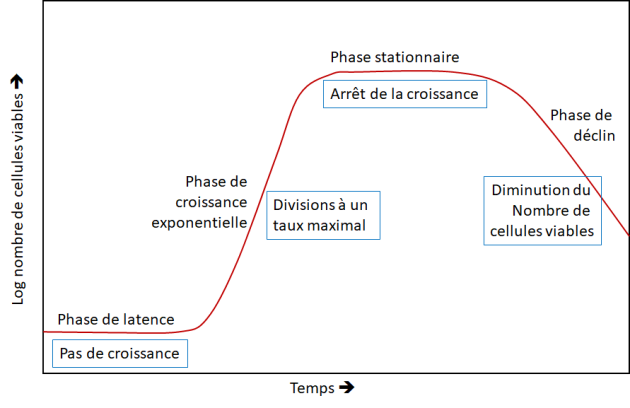
La plupart des micro-organismes présentent un temps de latence en début de culture, temps pendant lequel ils ne se multiplient pas, ou alors de façon marginale. Pour rappel, la courbe ci-dessous présente les différentes phases de croissance. Il est important de les prendre en compte pour un dimensionnement correct du fermenteur.
l'optimisation de la mise en œuvre d'un fermenteur doit prendre en compte le mode de fonctionnement : discontinu, discontinu alimenté ou continu.
Les fermenteurs en mode discontinu (Batch) sont beaucoup plus utilisés que les fermenteurs en mode continu, malgré une théorie solidement établie dans les deux cas. Cela est dû à une mise en œuvre plus simple en discontinu, une possibilité d'utiliser des fermenteurs de capacités importantes. Cette préférence est également due aux risques liés à d'éventuelles contaminations, risques plus importants en mode continu ou discontinu alimenté.
Dans certains cas, l'utilisation du mode discontinu alimenté (fed-batch) s'est développée, notamment lorsqu'il faut éviter les inhibitions par excès de substrat.