Technologies utilisées et productivité
Les technologies
Pour la culture des micro-algues, on distingue deux principales technologies :
- les open ponds ou raceways (chemins-de-course) qui sont des lagunes à faible profondeur d'eau pour permettre une pénétration suffisante de la lumière ; ils sont équipés de roues à aubes qui permettent de mélanger le contenu et éviter la sédimentation des micro-algues ; l'alimentation continue en CO2 permet également d'éviter la sédimentation de la biomasse. Ci-dessous une représentation schématique de ces raceways.
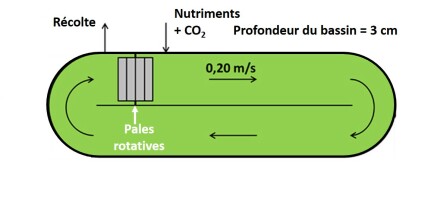
Ce sont des systèmes qui présentent des coûts d'investissement faibles, avec une facilité de changement d'échelle et un coût énergétique faible. En revanche, le fait qu'il s'agisse de systèmes ouverts augmente les risques de contamination. Les cultures peuvent être décimées en quelques jours. De plus, les concentrations obtenues en biomasse sont faibles (0,5 g de matière sèche/L).

- les systèmes fermés appelés photobioréacteurs avec des géométries très variées : plats, tubulaires, circulaires, etc. Le coût d'investissement est beaucoup plus important pour ces systèmes, le changement d'échelle est plus délicat. Les coûts énergétiques sont également beaucoup plus élevés. en revanche, comme ces systèmes sont fermés, ils sont beaucoup plus résistants aux contaminations et il est beaucoup plus facile de contrôler les conditions de culture. Les concentrations en biomasse peuvent atteindre 10 g/L et la productivité est 3 à 5 fois plus élevée que dans un raceway.
Le choix de la technologie dépend donc des caractéristiques de la micro-algue à cultiver et de la valeur ajouté des produits.


La productivité
Une prédiction de la productivité de plusieurs raceways situés à différents endroits (différentes latitudes) dans le monde a été effectuée et permet d'obtenir les résultats synthétisés dans le tableau ci-dessous :
CO2 fixé | CO2 fixé | Poids sec | Poids sec | Huile 60% | Huile 30% | Huile 60% | Huile 30% | |
|---|---|---|---|---|---|---|---|---|
Rendement | 9.9% | 3% | 9.9% | 3% | 9.9% | 9.9% | 3% | 3% |
unité | g/m²/J | g/m²/J | g/m²/J | g/m²/J | T/ha/an | T/ha/an | T/ha/an | T/ha/an |
Almeria | 198.7 | 60.2 | 108.6 | 32.9 | 237.8 | 118.9 | 72.1 | 36.0 |
Amsterdam | 108.9 | 33.0 | 59.5 | 18.0 | 130.4 | 65.2 | 39.5 | 19.8 |
Atacama | 237.7 | 72.0 | 129.9 | 39.4 | 284.5 | 142.2 | 86.2 | 43.1 |
Florence | 150.2 | 45.5 | 82.1 | 24.9 | 179.7 | 89.9 | 54.5 | 27.2 |
Honolulu | 191.6 | 58.1 | 104.7 | 31.7 | 229.3 | 114.7 | 69.5 | 34.7 |
Lisbonne | 181.9 | 55.1 | 99.4 | 30.1 | 217.7 | 108.8 | 66.0 | 33.0 |
Madrid | 172.9 | 52.4 | 94.5 | 28.6 | 206.9 | 103.4 | 62.7 | 31.3 |
Negev | 197.3 | 59.8 | 107.8 | 32.7 | 236.2 | 118.1 | 71.6 | 35.8 |
Nice | 163.9 | 49.7 | 89.5 | 27.1 | 196.1 | 98.1 | 59.4 | 29.7 |
Paris | 121.6 | 36.8 | 66.4 | 20.1 | 145.5 | 72.7 | 44.1 | 22.0 |
Perth | 216.1 | 65.5 | 118.1 | 35.8 | 258.6 | 129.3 | 78.4 | 39.2 |
Prague | 111.7 | 33.8 | 61.0 | 18.5 | 133.6 | 66.8 | 40.5 | 20.2 |
Rome | 150.4 | 45.6 | 82.2 | 24.9 | 179.9 | 90.0 | 54.5 | 27.3 |
Sahara | 224.7 | 68.1 | 122.8 | 37.2 | 269.0 | 134.5 | 81.5 | 40.8 |
Les productivités réelles sont quant à elles présentées dans le tableau suivant :
Type de culture | Espèce | Pays | Volume (L) | Productivité (g/m²/J) | Rendement réel (%) |
|---|---|---|---|---|---|
PBR air lift | Nannochloropsis sp. | Italie | 140 | 1.9-3.8 | 0.2-0.4 |
PBR plan incliné | Chorella sp. | République Tchèque | 2000 | 11.1 | 1.8 |
PBR plan incliné | Chorella sp. | Grèce | 2000 | 18.1 | 1.6 |
PBR tube incliné | Phaeodactylum tricornutum | Espagne | 200 | 32 | 2.9 |
Raceway | Spirulina platensis | Italie | 282 | 14.5 | 1.7 |
Raceway | Anabeana sp. | Espagne | 300 | 9.4-23.5 | 0.8-2.1 |
Raceway | Spirulina sp. | Espagne | 135000 | 2-17 | 0.2-1.6 |
Raceway | Spirulina platensis | Israël | 750 | 15-27 | 1.4-2.5 |
Raceway | Phaeodactylum tricornutum | Hawaii | 4150 | 2.4-11.3 | 0.2-1.1 |
Raceway | Pleurochrysis carterae | Australie | 160 | 16-33.5 | 1.3-2.8 |
Raceway | Dunaliella Salina | Australie | 110 | 20-37 | 1.7-3.1 |
On constate d'abord un résultat attendu, soit une forte variabilité en fonction de la latitude et des micro-algues cultivées. En revanche, les productivités sont plus faibles que celles estimées plus haut (entre 2 et 30 g/m²/j au lieu de 36 à 130 g/m²/j). De même, les rendements sont largement inférieurs aux rendements théoriques.
Comment expliquer ces écarts ?
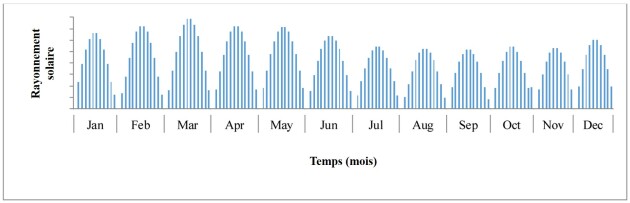
La principale explication réside dans le fait que ces systèmes, placés en milieu extérieur (que ces systèmes soient ouverts ou fermés), sont soumis à de fortes variations de luminosité et de température, comme le montrent les deux figures ci-dessous :
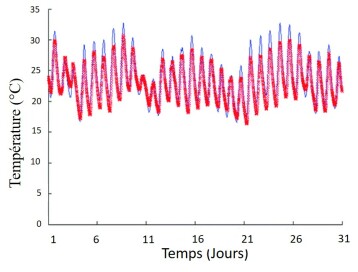
On remarque que la variation de la température peut être de l'ordre de 10°C et que la variation de la lumière, en plus d'être quotidienne, peut être importante à l'échelle d'un mois.
A l'échelle quotidienne déjà, les micro-algues peuvent passer par les différents stades présentés dans cette figure déjà commentée plus haut.[7] Ce passage quotidien de la photo-limitation à la photo-inhibition va se traduire par une modification importante de la capacité photosynthétique, ce qui va aboutir à une baisse de la productivité globale du système.
----
Comment expliquer ces écarts ? (1-accessibilité de la lumière)
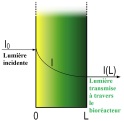
Un deuxième phénomène important intervient, celui de la qualité de la transmission de la lumière dans l'épaisseur du système, que ce soit à cause de sa profondeur ou à cause de la concentration cellulaire.
Sur le schéma ci-dessous, on voit que l'intensité lumineuse transmise aux micro-algues diminue avec l'épaisseur de la couche de milieu de culture qu'elle traverse.
Ce phénomène s'amplifie à mesure que les micro-algues se multiplient, comme le montre la courbe ci-dessous :
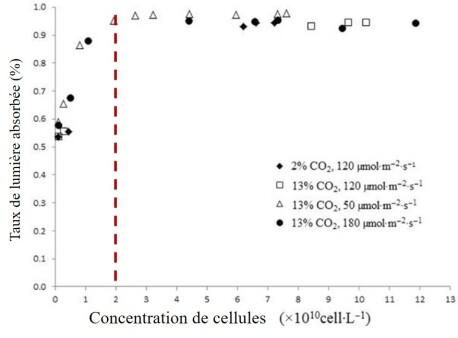
On observe qu'après une certaine accumulation de cellules dans le bioréacteur, la totalité de la lumière est absorbée. C'est le phénomène de photo-ombrage, qui va impacter la productivité : dans les zones sombres, le métabolisme des cellules devient respiratoire, il y a consommation du carbone cellulaire donc perte de productivité.
Le paramètre lumière est donc central dans la conception des photobioréacteurs. Le plus courant est alors d'utiliser des réacteurs très plats, à très faible épaisseur optique pour assurer de meilleures productivités.
---
Comment expliquer ces écarts ? (2- effet de la température)
La courbe ci-dessous montre que l'effet de la température sur la croissance des micro-algues rejoint classiquement l'effet qu'on observe sur la plupart des micro-organismes, avec un optimum de part et d'autre duquel le taux de croissance chute rapidement.
Ici l'exemple d'une souche d'A. formosa
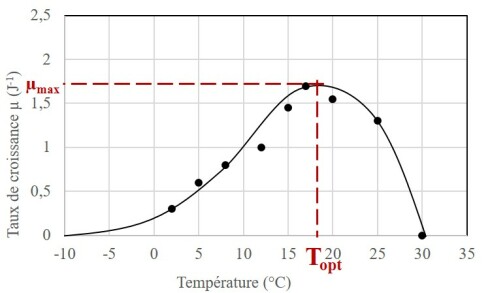
Or, lorsque les réacteurs sont placés à l'extérieur, les variations de températures peuvent être importantes comme déjà évoqué, et une partie de la biomasse n'y survit pas. Le réacteur est alors en partie de biomasse inactive qui contribue au photo-ombrage.
Complément :
D'autres paramètres contribuent à la modification de la productivité : dans le cas des réacteurs ouverts, la présence de contaminants et parasites affecte fortement la productivité ; l'évaporation modifie la concentration cellulaire et peut provoquer le photo-ombrage. Dans le cas des photobioréacteurs, l'accumulation et la non extraction d'oxygène peut modifier le métabolisme des cellules et provoquer l'accumulation de molécules oxydantes réactives ; le biocolmatage par encrassement des parois des photobioéacteurs provoque également le photo-ombrage.
Enfin, le CO2 peut être limitant surtuot dans les réacteurs ouverts, vu la relativement faible teneur en CO2 dans l'air. Il faut donc en général effectuer la régulation du pH de manière à le maintenir constant grâce à un apport supplémentaire de CO2.
Effet du CO2
L'apport de CO2 est assuré par son transfert du milieu gaz vers le milieu de culture liquide, selon l'équation classique :
\(\frac{d[CO_2]}{dt}=k_La\times([CO_2]^*-[CO_2])\)
où \([CO_2]^*\) représente la solubilité du CO2 dans le milieu liquide et est égal à \(\frac{pCO_2}{H}\), H étant la constante de Henry caractéristique du milieu de culture à la température d'étude.
Une fois dissous dans le milieu liquide, le CO2 subit les réactions acido-basiques suivantes :
CO2(g) \(\Longleftrightarrow\) CO2(d)
CO2(d) + H2O \(\Longleftrightarrow\)H2CO3
H2CO3 \(\Longleftrightarrow\) HCO3- + H+
HCO3- \(\Longleftrightarrow\) CO32- + H+
Et on obtient les expressions suivantes pour le CO2 et le carbone inorganique total (CIT) :
\([CO_2]=\frac{[CIT]}{1+\frac{K_I}{[H^+]}+\frac{K_1K_2}{[H^+]^2}}\)
\([CIT]=[CO_2]+[HCO_3^-]+[CO_3^{2-}]\)
La courbe de spéciation du CO2 dissous est présentée ci-dessous :
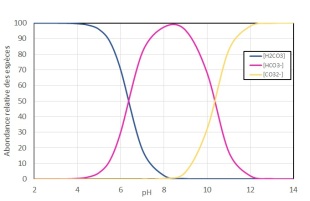
La biodisponibilité du CO2 pour les micro-algues va donc dépendre du pH et de la température. La plupart des micro-algues peuvent consommer le CO2 tandis que quelques unes peuvent utiliser le HCO3-.
En conclusion
On vient de voir que dans les réacteurs, les mécanismes en jeu sont complexes : les phénomènes physiques (tes que les transferts gaz-liquide), chimiques (comme les réactions d'oxydo-réduction), biologiques (la croissance) et biochimiques (production de métabolites d'intérêt).
On a également vu qu'en extérieur, les productivités étaient faibles à cause de la variabilité inévitable des conditions opératoires.
en conséquence, pour maximiser la productivité, les principales pistes envisagées consistent soit à améliorer le design des réacteurs, soit à mettre en place des stratégies de contrôle-commande pour maintenir les micro-algues dans les conditions optimales. Ce sont ces deux pistes qui seront développées dans la partie suivante.