Facteurs affectant le transfert d'oxygène en bioréacteur
La vitesse de transfert d'oxygène du milieu gaz vers le milieu liquide est affectée par des facteurs qui peuvent modifier le coefficient linéaire de transfert kL, l'aire interfaciale a ou le gradient de concentration ([O2]*-[O2]). Pour un même milieu de culture, la valeur de kL varie peu. A l'inverse, la valeur de a peut être significativement modifiée (de plusieurs ordres de grandeur) selon les conditions opératoires. Dans l'amélioration du kLa dans un procédé, c'est donc sur l'augmentation de l'aire interfaciale qui est prioritairement recherchée. Les valeurs typiques de kLa rencontrées dans les procédés industriels varient entre 0,02 s-1 et 0,25 s-1.
Ci -dessous sont présentés les principaux paramètres qui influencent l'aire interfaciale totale dans un bioréacteur.
Les bulles
Dans les procédés de culture en milieu liquide, les bioréacteurs instrumentés sont équipés de diffuseurs d'air situés en-dessous du mobile d'agitation. Pour les bioréacteurs de laboratoires (500 mL à quelques litre), tout le milieu liquide se trouve à proximité du mobile d'agitation et la dispersion des bulles dans tout le volume du réacteur est relativement efficace. De même, les bulles sont fréquemment soumises au cisaillement. A l'inverse, dans la plupart des procédés à grande échelle, après une première dispersion suite à leur sortie du diffuseur, la plupart des bulles passent l'essentiel de leur temps de séjour dans le réacteur éloignées du mobile d'agitation et ses cisaillements, donc avec des performances de transfert gaz-liquide amoindries. Il s'agit d'une conséquence inévitable de changement d'échelle. La puissance d'agitation dans un bioréacteur de laboratoire se situe autour de 10-20 kW.m-3 alors que celle des bioréacteurs industriels est autour de 0,5 à 5 kW.m-3.
Importance de la taille des bulles
- Plus la taille des bulles est petite, plus l'aire interfaciale gaz-liquide est élevée. Donc le le kLa s'en trouve augmenté et ainsi la vitesse de transfert gaz-liquide.
- Plus les bulles sont petites, plus leur vitesse de remontée à la surface est faible, ce qui correspond à une rétention de gaz élevée dans le milieu liquide et augmente le temps disponible pour la dissolution de l'oxygène dans le milieu liquide.
Cependant, il existe une limite à la diminution de la taille des bulles. En effet, la concentration d'oxygène s'équilibre entre le gaz et le liquide au bout de quelques secondes. Au-delà, il est nécessaire de renouveler les bulles d'air dans le milieu, donc de chasser les précédentes. Des bulles de trop petite taille (<< 1 mm) séjourneraient trop longtemps de le milieu liquide. Ce problème se trouve aggravé dans le cas de milieux non-newtoniens de viscosité élevée, où il faudrait privilégier des bulles de gaz de taille élevée.
Le diffuseur, l'agitation, et les propriétés du milieu de culture
formation des bulles
Dans les bioréacteurs à petite échelle, les bulles d'air sont formées au niveau des diffuseurs. Ces derniers peuvent être poreux, en métal, verre ou céramique frittés. Leurs performances sont limitées car ces diffuseurs opposent une résistance importante au flux de gaz.
Des diffuseurs perforés peuvent être utilisés, sous forme d'anneau avec plusieurs orifices permettant de multiples sorties de bulles couvrant une surface plus importante du réacteur.
La taille des bulle est initialement imposée par la technologie de diffuseur utilisé. Cependant, une fois dans le milieu liquide, la taille des bulles est essentiellement contrôlée par le système d'agitation et de cisaillement utilisé.


Dispersion du gaz
Le rapport entre vitesse d'agitation et débit d'aération permet de déterminer si le bioréacteur fonctionne en sous-charge, en engorgement, ou en dispersion optimale des bulles (voir les schémas ci-dessous).
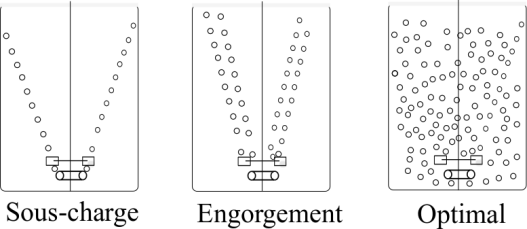
La qualité de la dispersion des bulles dépend également de la géométrie du mobile utilisé. Le schéma ci-dessous présente les différentes géométries possibles.
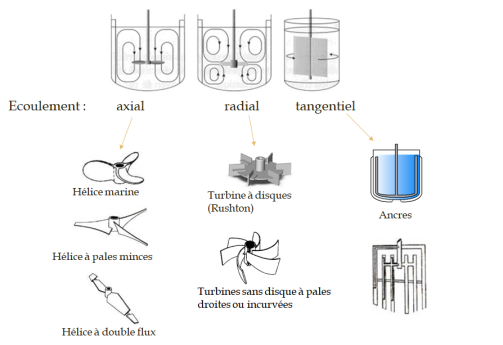
Dans les bioréacteurs à l'échelle de laboratoire, ce sont souvent les turbines de type Rushton qui sont utilisées.
L'efficacité de ces mobiles dépend des régimes d'écoulement. Pour rappel, en cuve agitée, le nombre de Reynolds se calcule comme suit :
\(Re=\frac{\rho\times N \times D^2}{\mu}\)
où :
ρ : masse volumique du fluide (kg.m-3)
D : diamètre du mobile d'agitation (m)
N : vitesse de rotation du mobile d'agitation (tr.s-1)
µ : viscosité dynamique du fluide (Pa.s)
La puissance d'agitation (P en W) peut être calculée comme suit :
\(P=N_P\times\rho\times N^3 \times D^5\)
Où NP est défini comme étant le nombre de puissance et correspond à l'expression adimensionnelle de la puissance consommée. Il varie en fonction de Re lorsque le régime est laminaire et est constant pour chaque type de mobile lorsque le régime est turbulent. Les valeurs types sont présentées dans l'abaque ci-dessous :
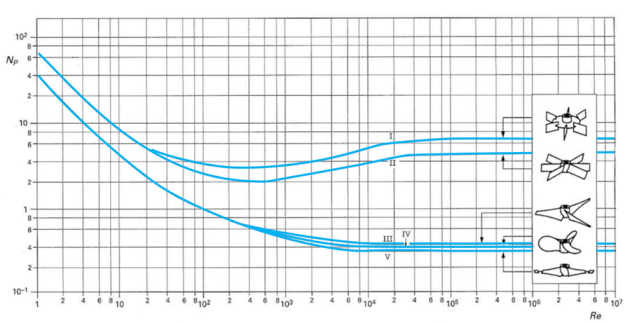
Il faut noter que pour l'amélioration du kLa, l'augmentation de la vitesse d'agitation a un effet significatif alors que l'augmentation du débit de gaz a un faible effet.
Coalescence des bulles
La coalescence de petites bulles en plus grandes bulles dans le bioréacteur est à éviter, parce qu'elle résulterait en une diminution de l'aire interfaciale. Dans les milieux coalescents tels que l'eau, la collision entre bulles aboutit à leur fusion alors que dans les milieux non coalescents, les effets de tension de surface les empêche de fusionner. Dans les milieux non coalescents, la taille des bulles reste stable entre le moment où elles sont libérées par le diffuseur et le moment où elles s'échappent du milieu liquide.
Les propriétés de coalescence des milieux de culture dépendent de leur composition. La présence de sels et d'ions a tendance à supprimer la coalescence, ce qui est un avantage pour le transfert d'oxygène dans ces milieux, comme le montrent les courbes ci-dessous.
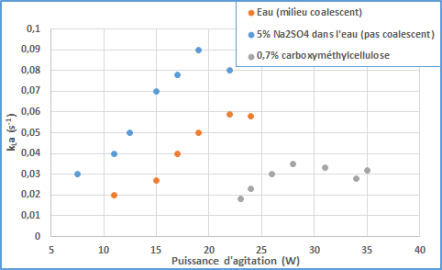
Viscosité du milieu
L'effet de la viscosité est visible sur la figure ci-dessus : l'ajout de carboxyméthyl cellulose augmente considérablement la viscosité du milieu, ce qui résulté en une baisse importante des propriétés de transferts du milieu (penser à la diminution importante de Re).
Les agents anti-moussants
Dans la plupart des milieux de culture, on retrouve plusieurs agents moussants : des protéines, des polysaccharides, etc. L'aération du milieu de culture par barbotage d'air comprimé peut donc facilement conduire à la formation importante de mousse, qui peut avoir des conséquences néfastes sur le déroulement du procédé : perte de milieu de culture par évacuation de mousse depuis l'espace de tête du fermenteur, détérioration des parois cellulaires par éclatement des bulles de mousse, pour les cellules les plus fragiles, etc.
Il peut donc être nécessaire d'ajouter des agents anti-moussants dans le milieu de culture.
L'effet immédiat de ces agents est de diminuer la tension de surface, ce qui diminue la taille moyenne des bulles, donc augmente l'aire interfaciale, ce qui est bénéfique pour le transfert d 'oxygène. Cependant, l'autre effet direct est une baisse de la mobilité à l'interface gaz-liquide, ce qui diminue la valeur de kL. En général, l'augmentation de a ne compense pas la diminution de kL et l'effet global des agents anti-moussants est donc de détériorer la qualité du transfert gaz-liquide.
Afin de pallier cette difficulté, des systèmes mécaniques de rupture des bulles de mousse sont parfois privilégiés par rapport aux méthodes chimiques mais leurs coûts de fonctionnement limitent leur usage.
Complément : Pour en savoir plus sur l'agitation
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger la vidéo.